<2.3 이온의 이동>
전해질의 이온 전도는 이온 이동에 기반한다. 이온이 이동하는 원인은 세 가지이다.
(1) 확산(diffusion)
용액 속 어느 한 공간의 농도가 높으면, 농도가 높은 곳으로부터 낮은 곳으로 이온이 확산된다.
(2) 전기장 이동(migration)
전기 퍼텐셜 차이(전기장)가 존재하면, 양이온은 (-)극으로 음이온은 (+)극으로 이동한다.
= 전기장의 영향으로 이온이 이동하는 현상
(3) 대류(convection)
확산과 전기장 이동에서 용매는 정지해 있고, 이온만 이동한다. 압력, 온도 또는 밀도 등의 차이에 의하여 용매 자체가 이동하면, 용매와 함께 이온도 이동한다. 이러한 이동을 대류라고 한다.
수용액 속 이온의 이동은 농도 차이에 의하여 확산(diffusion)하며, 전위 차이에 의하여 전기장 이동(migration)한다.
이온은 질량이 있는 입자이므로 이동하기 위해서는 힘이 필요하다. 이 힘은 어떻게 만들어지는지 확인 한다. 이온이 이동하기 위해서는 거리 차이 dx에 따른 퍼텐셜 차이가 만드는 힘 F가 필요하다.
(1) 확산
확산은 화학 퍼텐셜(𝜇)의 차이에 기인하므로 이온 한 개의 확산을 유발하는 힘 Fd는 다음과 같다.
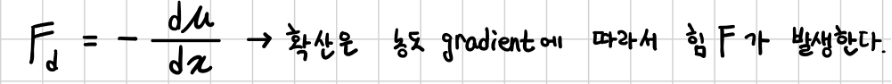
(2) 전기장 이동
전기장 이동은 전극 사이의 전압인 전기 퍼텐셜(Ψ)의 차이에 기인하므로 전하량이 +ze인 이온 한 개 의 전기장 이동을 초래하는 힘 Fm은 다음과 같다.
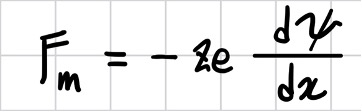
다시 말해, 확산은 거리 차이에 따른 화학 퍼텐셜 차이, 전기장 이동은 거리에 따른 저기 퍼텐셜 차이에 의하여 발생하는 현상이다.
화학 퍼텐셜과 전기 퍼텐셜 기울기에 영향을 받는 이온은 이동하며, 동시에 열에너지에 의한 무작위 걸음음 통해 이동한다. 무작위 걸음만을 고려한다면 결국 이온의 평균 위치는 변화가 없다. 하지만 이온을 이동시키는 힘이 있다면 얘기는 달라진다. 이온을 이동시키는 힘 F가 존재할 때의 그림(b)를 살펴본다.
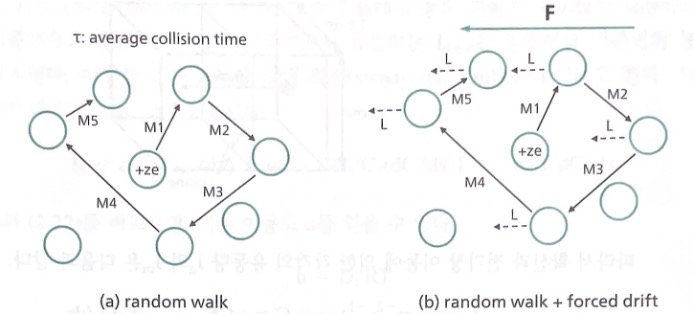
힘 F에 의하여 이온은 왼쪽으로 가속되어 시간 𝜏동안 거리 L을 이동한다. 충돌 직후 이온은 이동 M1 의 과정에서 얻은 속도를 모두 잃는다고 가정하면, 이동 M2의 과정에서 이온은 속도 0에서 다시 F에 의해 가속되어 L만큼 이동한다. 이러한 이동을 N번 하면 무작위 걸음에 의한 위치 변동은 없겠지만, L 의 방향은 일정하므로 F에 의해 영향을 받는 위치 이동은 NL만큼 왼쪽으로 이동하게 된다. 다시 말해 이온은 충돌과 다음 충돌까지 L/𝜏라는 일정한 평균속도로 이동한다. 이 평균 속도가 흐름 속도 𝑣((drift velocity)이다. Drift velocity는 다음과 같이 표현된다.

m은 이온의 질량이다. F는 화학 또는 전기 퍼텐셜과 관련되어 있으므로 이온과는 상관없는 물리량이 다. 그러나 ( 𝝉 )는 이온의 개별 이동 특성을 반영하는 물리량으로 이동도(mobility) u를 아래와 같이 정의한다.

u는 이온 한 개에 관한 식
따라서 확산과 전기장 이동에 의한 각각의 Flux인 Jd와 Jm은 다음과 같이 쓸 수 있다.

이온 한 개에 관한 힘 F를 농도 C로 곱한 값이 Flux(J)이다.
위의 식은 매우 중요하다. 확산과 전기장 이동은 다르게 보이지만, 모두 mobility u에 비례한다. 확산과 전기장 이동의 차이점은 공간적으로 변화하는 퍼텐셜 종류이다. 확산에서는 화학 퍼텐셜이고, 전기장 이동에서는 전기 퍼텐셜이다. 그러므로 이온 이동을 설명하는 근본이 mobility, u이다.
'Electrochemistry' 카테고리의 다른 글
| [Electrochemistry] 전기화학 전지의 전위차 측정(1) (3) | 2024.09.02 |
|---|---|
| [Electrochemistry] 전지 전해질과 이온 이동(3) (0) | 2024.08.30 |
| [Electrochemistry] 전지 전해질과 이온 이동(1) (1) | 2024.08.23 |
| [Electrochemistry] 전기화학의 전지(3) (0) | 2024.08.15 |
| [Electrochemistry] 전기화학의 전지(2) (0) | 2024.08.15 |