전기화학 전지의 전위차는 각 전극의 환원 반응성 차이를 의미한다. 그러므로 올바르게 측정된 전지의 전위차는 전극의 반응성을 파악할 수 있는 매우 중요한 관찰이다. 또한 전해 전지에서는 전지의 전위차(전압)를 제어하여 전기화학 반응의 반응성을 조절한다. 전지의 전위차를 측정하는 기술인 potentiometry(전위차법)을 소개한다.
<3.1 환원 전위 측정을 위한 전지>
그림(a)에서 평형에 도달한 산화 전극과 환원 전극의 개별 반응은 아래와 같다.

산화 전극은 Ag wire에 AgCl을 도포한 Ag/AgCl 전극과 KCl 포화 전해질(4.2M)로 구성되어 있다. Ag/AgCl 산화 전극의 환원 전위는 SHE 전극에 대하여 +0.197 V이다. 한편 산화 전극과 환원 전극의 전해질은 다공성 유리막(porous glss membrane)으로 연결되어 있다. 산화 전극과 환원 전극의 전해질 은 다공성 유리막의 연결된 많은 작은 구멍(pore)들을 채우게 된다. 따라서 두 전해질은 전기적으로 접 촉하지만 쉽게 혼합되지 않으며, 두 용액의 접촉면을 통하여 이온 전도가 가능하다. 다공성 유리막을 사용하면 염다리의 번거로움을 피할 수 있다. 전압계의 (-)단자를 Ag/AgCl 전극에 연결하여 전지 전압 을 측정하면 관심 대상인 산화/환원 쌍의 환원 전위(E_Ox/Red)를 계산할 수 있다.

그림(a)의 산화 전극을 더 편리한 형태로 바꿀 수 있다. 점선으로 표시한 부분을 그림(b)와 같이 간단히 유리관 안에 넣을 수 있다. 이러한 전극을 이용하여 그림(a)와 같은 개념으로 구성한 전지가 그림(c)이다.
[산화 전극의 반응]

그림(b)에서 Cl-의 농도만 일정하게 유지된다고 하면 산화 전극 전위는 일정하게 유지되고, 전지 전압 측정의 편리한 기준으로 사용할 수 있으므로 유리막을 포함한 산화 전극을 기준 전극(reference electrode)이라고 한다. 반면 관심대상인 산화/환원쌍의 환원 전위를 나타내는 환원 전극을 지시 전극(indicator electrode)라고 한다. 이러한 방법을 통하여 관심 대상인 산화/환원쌍의 환원 전위를 측정하는 기술이 전위차법(potentiometry)라고 한다.
전위차법으로 측정된 전지 전압은 기준 전극에 대한 지시 전극의 전위차임을 기억해야 한다. 만약 이 값이 양수라면, 지시 전극의 환원 전위가 기준 전극의 환원 전위보다 더 큼을 의미한다. 따라서 기준 전극을 (-)단자(ground)에 연결해야 한다.
<3.2> 농도와 전지 전압
전위차법으로 측정된 지시 전극 전위와 화학을 연결할 수 있다. 그 실마리는 전지가 에너지 변환 장치라는 것에서 시작한다. 전지는 화학 에너지를 전기 에너지로 바꾸어 두 전극에 연결된 부하가 전기적인 일(Work)을 하는 장치이다.
구체적으로 화학 에너지와 전지적인 일의 관계를 살펴본다. 아래 그림에서 표준 상태에 있는 Zn과 Cu의 전지가 열역학적 system이고, 전지와 연결된 부하가 surrounding이다.
아래의 반응이 표준 상태에서 열역학적 가역 과정을 따라 진행한다고 가정하자.

화학의 관점에서 system의 화학 에너지 변화 ∆𝑮° 𝒓𝒙𝒏 을 계산할 수 있다. ∆𝑮° 𝒓𝒙𝒏 는 표준 생성 Gibbs 자유
에너지 ∆𝑮𝒇를사용하여 표현된다.

전기의 관점에서 주위가 받은 일을 계산해 본다. Zn 원자 한 개가 Cu2+ 이온 한 개에 두 개의 전자를 전달하는 2 전자 과정이므로, 1mol의 Zn가 반응하면 2mol의 전자가 전기화학 셀을 통해 이동하면서 일을 한다. 정의에 따라 전기적인 일 W를 전하량 Q와 전압 E로 표현하면 다음과 같다.

평형을 유지하면서 반응이 진행하는 열역학적 가역 과정을 가정했으므로, 화학 에너지의 변화 ∆𝑮° 𝒓𝒙𝒏 는 부하에 의하여 모두 전기적인 일 W로 변환된다. 계의 에너지는 ∆𝑮°𝒓𝒙𝒏 만큼 낮아졌고 주위는 W만큼 에너지를 얻었다.

이는 반응 Gibbs 자유 에너지 변화가 전지 전압과 전하량으로 나타난다. 위의 식은 열역학적 가역 과정의 조건에서 성립함을 기억해야 한다.
그렇다면 비표준상태에서 전지 반응이 진행된다면 어떤 일이 발생할까? 비표준 상태에서 임의의 물질 X의 Gibbs 자유 에너지는 다음과 같이 표현된다.
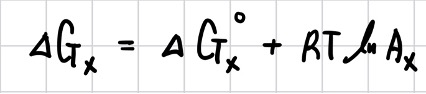
활동도는 형식 농도[X]와 활동도 계수 fX로 다음과 같이 표현된다.

다음과 같이 Cu2+이온과 Zn2+이온의 활동도가 1이 아닌 비표준 상태에서 가역적 반응이 진행되는 경우를 생각해 본다.
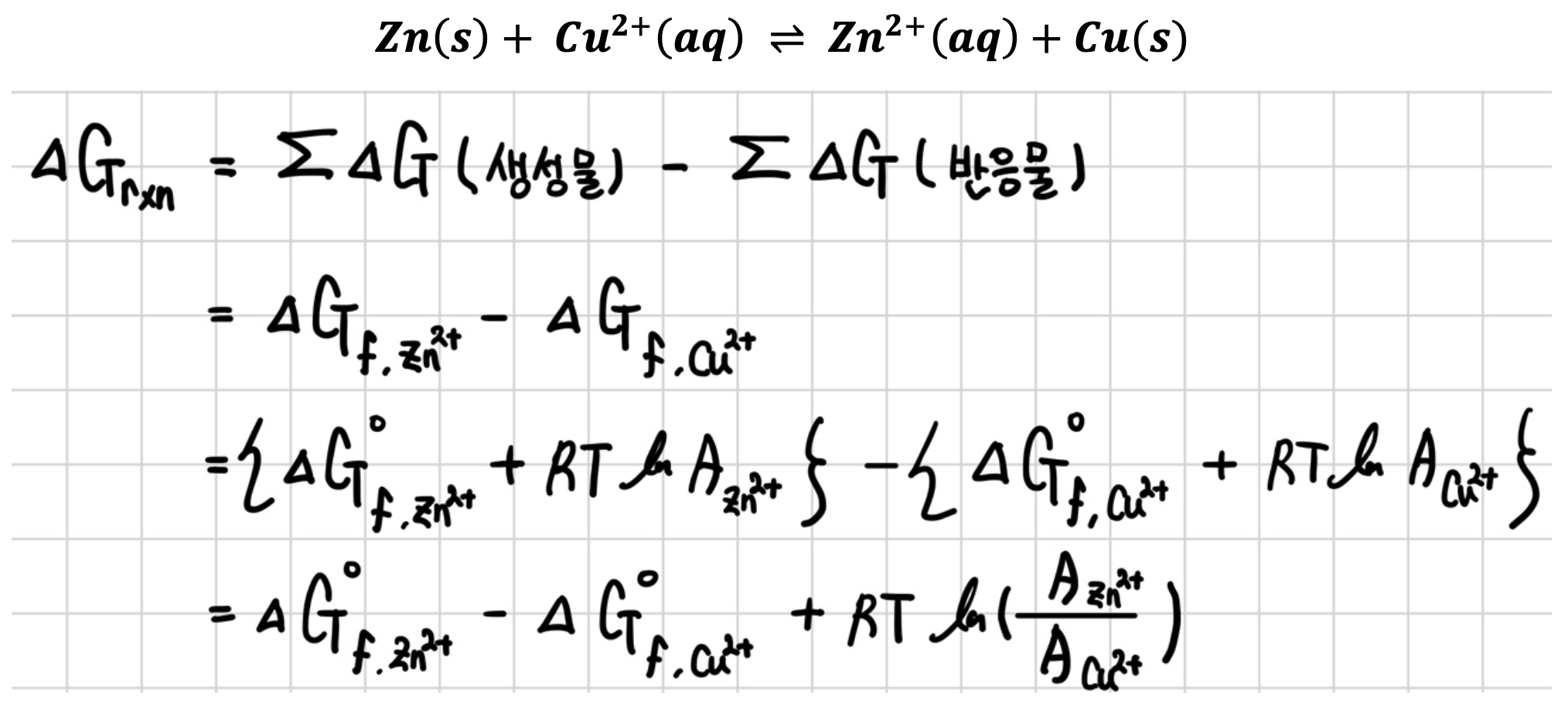
고체 Zn과 Cu의 활동도는 1.

위의 식을 통해 Nernst Equation을 유도할 수 있다.
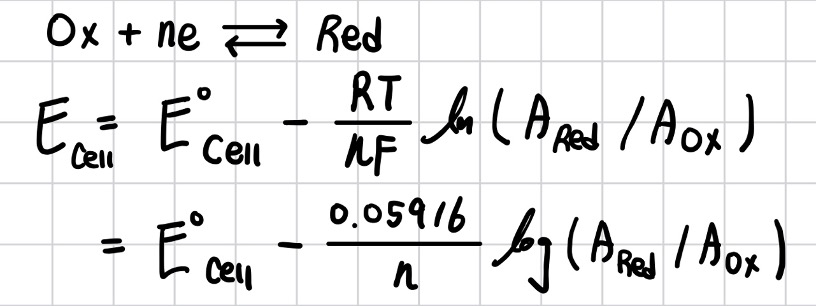
Nernst 식과 관련하여 기억해야 하는 두 가지가 있다. 첫째, Nernst 식은 열역학에 근거하여 유도된 식으로 평형 상태에 있는 경우에만 적용할 수 있다. 전류가 흐르는 상황은 열역학적으로 비평형 동적(dynamic) 상황이므로 Nernst 식을 적용할 수 없다.
둘째, 활동도 계수는 이온 세기에 의존한다. 예를 들어 Zn2+이온의 활동도 계수는 0.1M ZnSO4 수용액과 0.1M ZnSO4 + 0.1M NaCl 혼합 수용액에서 다르다. 아래의 표는 Fe3+/Fe2+ 산화/환원쌍 환원 전위가 용액의 환경에 따라 크게 변함을 예시한다.
환경에 따라 활동도 계수 f가 변하므로, Ecell은 특정 환경에서 측정한 환원 전위가 되며, 이를 형식 환원 전위(formal reduction potential)라고 한다.

'Electrochemistry' 카테고리의 다른 글
| [Electrochemistry] 전류가 흐르는 전지와 과전압(1) (0) | 2024.09.15 |
|---|---|
| [Electrochemistry] 전기화학 전지의 전위차 측정(2) (1) | 2024.09.06 |
| [Electrochemistry] 전지 전해질과 이온 이동(3) (0) | 2024.08.30 |
| [Electrochemistry] 전지 전해질과 이온 이동(2) (0) | 2024.08.30 |
| [Electrochemistry] 전지 전해질과 이온 이동(1) (1) | 2024.08.23 |