<2.4 전기화학 퍼텐셜, 운반율과 접촉 전위>
[전기화학 퍼텐셜]
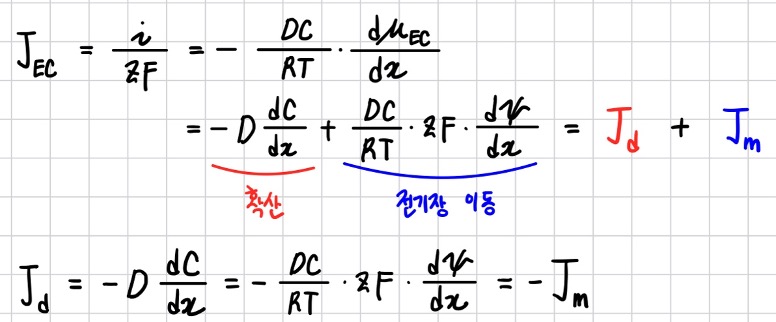
이온은 화학 퍼텐셜 차이에 의한 확산과 전기 퍼텐셜 차이에 의한 전기장 이동을 통해 전해질 속을 이동한다. 그리고 이 둘은 서로 연결되어 있다. 아래 그림과 같이 +ze 전하를 가지고 농도가 C인 양이온이 농도 기울기와 전기장의 영향에 동시에 놓여 있는 상황을 생각해 본다.

이온 주변의 농도 기울기 때문에 양이온은 화학 퍼텐셜이 낮은 왼쪽으로 이동하고, 동시에 양이온은 전기장의 영향을 받으므로 전기 퍼텐셜이 낮은 오른쪽으로 이동할 것이다. 퍼텐셜 중첩의 원리에 따라 야이온이 느끼는 퍼텐셜은 화학 퍼텐셜과 전기 퍼텐셜의 합이다. 그 합이 전기화학 퍼텐셜 (electrochemical potential, 𝜇EC)이며, 아래와 같이 표현한다.
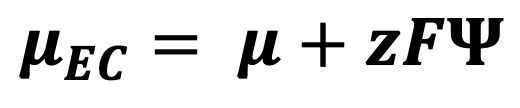
𝜇는 1mol에 대하여 정의하고, Ψ는 전하 1C에 대한 정의이다. 이온 1mol은 전하량 zF에 해당하므로 Ψ 와 zF를 곱하면, 두 퍼텐셜은 이온 1mol을 기준으로 정의되는 값이 된다. 전기화학 퍼텐셜을 사용하면, 위의 그림과 같은 상황에서 이온의 이동을 설명하기가 편리해진다.
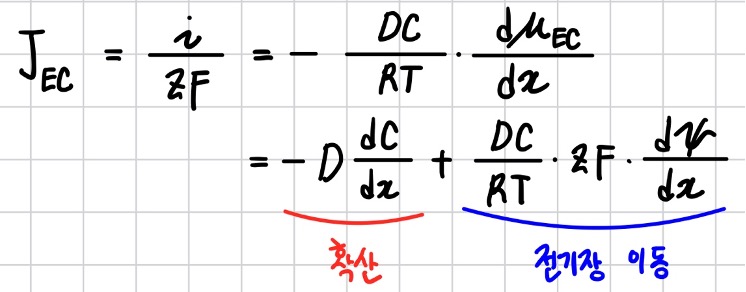
전기장의 세기가 크지 않는 조건에서 Flux와 전기화학 퍼텐셜의 관계를 유도하는 과정은 매우 복잡하 므로 그 결과만 다뤄본다.
[𝑨𝒈(𝑪𝑵𝟐)]-(𝒂𝒒) + 𝒆 → 𝑨𝒈(𝒔) + 𝟐𝑪𝑵-(𝒂𝒒)의 반응을 생각해 본다.
이 반응은 결국 전자를 받는 환원반응으로 전자를 제공할 수 있는 Anode에서 일어나는 반응일 것이 다. Anode는 전위가 낮으므로 음이온 반응물 [𝐴𝑔(𝐶𝑁2)]-은 Anode 쪽으로 전기장 이동이 쉽지 않다. 그러나 Anode 전극에서 [𝐴𝑔(𝐶𝑁2)]- 음이온이 소비되므로 농도 기울기가 존재하게 되어 [𝐴𝑔(𝐶𝑁2)]4-음이온은 Anode 전극으로 확산한다. 확산 Flux가 전기장 이동 Flux보다 크다면, [𝐴𝑔(𝐶𝑁2)]- 음이온은 Anode로 이동하여 위의 환원반응이 일어나게 된다.
[운반율]
이온의 이동은 농도 기울기와 전기 퍼텐셜 기울기에 기인한다. 그렇다면 동일한 조건에 놓인 이온들은 동일한 양의 전류를 운반할까? 결론은 ‘아니다’이다. 간단한 설명은 개별 이온들을 둘러싼 이온 분위기 의 크기가 다르므로 이온의 이동 속도에 차이가 발생한다. 이동 속도의 차이와 농도는 개별 이온이 운 반하는 전류의 크기 차이를 유발한다.
다양한 이온이 있는 전해질의 이온 전도도는 존재하는 모든 이온의 이동에 의한다. 그러나 각 이온의 이동 속도가 다르므로, 특정한 이온이 전체 전류에 기여하는 정도가 다르다.
이온 j가 운반하는 전류 𝑖 가 전체 전류 𝑖 에 대한 분율로 이온 j의 운반율(transference number) 𝑡j 를 다음과 같이 정의한다.
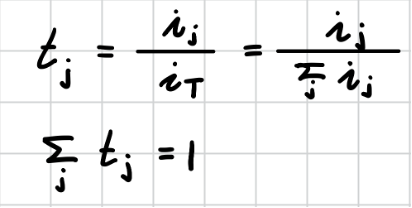
운반율은 이온 j의 이동 속도의 차이에 기인하므로, mobility로 다음과 같이 표현할 수 있다.

[접촉 전위]
아래 그림과 같이 농도가 다른 두 전해질이 이온만 통과시키는 막으로 분리되어 혼합되지 않고, 접촉 만 하는상황을 생각해본다. 전극이 없으므로 외부전기장도 없다.접촉면을 경계로 농도차이가 있으므로 왼쪽 전해질에 있는 이온은 오른쪽 전해질로 확산 이동한다. 양이온의 mobility가 음이온의 mobility보다 크다면, 양이온이 음이온보다 먼저 접촉면을 넘는다. 양이온이 계속 오른쪽으로 이동하면 접촉면에서 뒤따르는 음이온과 앞서 막을 통과한 양이온 사이에 인력이 발생하여 양이온과 음이온의 이동이 모두 정지된다.
결국 (b)와 같이 양이온과 음이온의 공간적 분리가 발생하여, 전위차(전압)를 유발한다. 이온이 확산하여 형성된 전하 분리가 만드는 전위차를 확산 전위(diffusion potential)라고 한다. 두 전해질이 접촉했을 때 생성된다고 해서 접촉 전위(junction potential)라고도 하며, 막 전위 (membrane potential)라고도 한다.
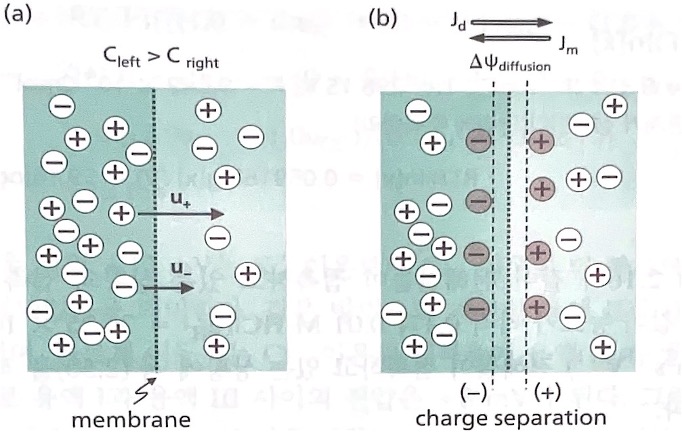
이온 이동이 정지된 상황은 확산 유동량 Jd와 확산 전위에 의한 전기장 이동 유동량 Jm의 방향이 서로 반대이고 그 크기는 같음을 의미한다.
위의 식을 dx에 대하여 적분하여 정리하면 junction potential ∆Ψ와 농도 C와의 관계식을 얻을 수 있다.
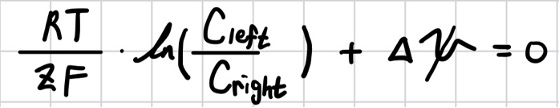
위의 식은 막을 경계로 농도 차이에 의한 화학 퍼텐셜 차이가 전기 퍼텐셜 차이인 전압 junction potential ∆Ψ로 나타난다.
확산 전위가 형성되기 위해서는 전하의 이동이 필요하다. 따라서 앞서 배운 운반율, transference number 개념으로도 식을 유도할 수 있다. 한 단계 더 들어가면, 운반율은 또 이온의 mobility로도 표 현하기 때문에 결국 junction potential은 이온의 mobility로 표현 가능함을 알 수 있다. Junction potential은 접촉 용액의 활동도 차이(농도 차이)와 구성 이온의 mobility의 차이에 기인한다는 사실을 알아야 한다.
그림과 같이 전해질들이 접촉하고 있는 상황의 junction potential을 계산한다.
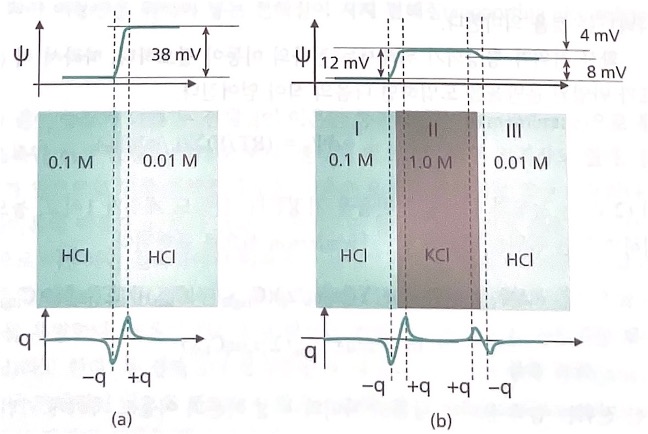
계산된 접촉 전위 38mV는 (a)의 윗부분에 표시한 것과 같이 0.01M HCl 전해질의 전위가 더 높음을 의 미한다. 이는 H+ 이온이 더 빠르므로 0.01M 전해질에 양의 전하층이 생기고, 상대적으로 느린 Cl- 이 온이 0.1M 전해질에 남아 음의 전하층을 생성함을 의미한다.
(b)는 0.1M HCl 전해질과 0.01M HCl 전해질을 사이에 두고 접촉하고 있는 상황이다. 이때 KCl 전해질 은 두 HCl 전해질을 연결하는 염다리이다. 용액 I과 II사이의 접촉 전위 +12mV는 K+ 이온보다 Cl-이온 이 더 빠르므로 용액 I에 Cl-에 의한 음이온 층이 형성되었음을 의미한다. 용액 II와 III 사이의 접촉 전 위는 -4mV이며, 빠르게 이동하는 Cl- 이온의 전하층이 용액 III에 생성되었다는 것을 알 수 있다. 그러 므로 용액 I과 III 사이의 전압은 +8mV가 된다.
(a)에서 이동도 차이가 큰 이온들로 구성된 HCl 전해질의 접촉 전위는 38mV로 크지만, 이동도가 비슷 한 KCl전해질로 두 전해질을 연결하면 접촉 전위를 8mV로 줄일 수 있다. 그러므로 염다리에 사용되는 전해질은 구성 이온의 이동도가 비슷해야 한다.
'Electrochemistry' 카테고리의 다른 글
| [Electrochemistry] 전기화학 전지의 전위차 측정(2) (1) | 2024.09.06 |
|---|---|
| [Electrochemistry] 전기화학 전지의 전위차 측정(1) (3) | 2024.09.02 |
| [Electrochemistry] 전지 전해질과 이온 이동(2) (0) | 2024.08.30 |
| [Electrochemistry] 전지 전해질과 이온 이동(1) (1) | 2024.08.23 |
| [Electrochemistry] 전기화학의 전지(3) (0) | 2024.08.15 |