<4.3> 분극 곡선
전기화학 반응과 관련된 과전압을 어떻게 측정할 수 있을까? 과전압을 측정해야 전극과 산화/환원쌍이 결합한 반응계의 반응속도를 평가할 수 있다. 과전압에 대한 정보는 전류와 전압의 상호 관계를 표현 하는 전류-전압 곡선(i-E 곡선)에 있다.
전기화학 반응계가 주어진 전지 전압 E와 그 전압에서 Steady state에 도달하였을 때 관찰되는 전류 i 인 관계인 i-E 곡선을 분극 곡선(polarization curve)이라 한다. 먼저 분극(polarization)을 이해해야 한 다. 커패시터의 두 전극에 전압을 인가하여 충전하는 과정을 ‘분극한다(polarize)’라고 한다. 커패시터에 전압을 인가하지 않으면, 양전하의 중심과 음전하의 중심이 일치된 상태, 즉 커패시터의 두 전극은 비 분극된(unpolarized) 상태에 있다. 그러나 전압을 인가하면 커패시터의 두 전극으로 양전하의 중심과 음전하의 중심이 분리되는 상태, 즉 커패시터의 두 전극은 분극된 상태가 된다.
다시 말해, 커패시터를 분극하는 과정에서 외부 전력공급장치가 커패시터의 두 전극에 양전하와 음전하를 공급하여(=전류를 흘려) 두 전극을 충전하지만, 저항이 무한대인 유전체를 통하여 전류는 흐르지 않는다. 이 과정을 분극 이라고 한다. 그러므로 분극과정에서 커패시터는 충전된다. 그러나 실제 유전체의 저항은 무한대가 아 니며, 허용된 전압 이상의 전압이 인가되면 유전체에 전류가 흘러 커패시터는 충전된 전하를 보관할 수 없으므로, 충전 기능을 잃게 되어 비분극화된다.
커패시터의 유전체를 전기화학 반응이 일어나는 전해질로 바꾸어 설명한다. 전극의 전하 및 물질 전달 저항이 무한대이면, 전극에 전위를 인가하더라도 전류가 흐르지 않으므로 커패시터의 분극 현상과 같 은 현상이 전극에 일어난다. 그런 전극을 이상적 분극 전극(ideally polarizable electrode) 이라고 한다.
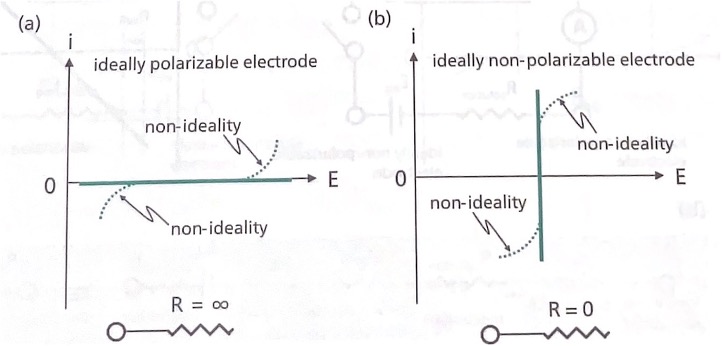
그림(a)에 묘사한 바와 같이 전극에 전위를 인가하여도 전류가 흐르지 않는다. 과전압의 관점에서 보면 이상적 분극 전극의 전하 전달 과전압이 무한대 이므로, 전기화학 반응이 진행되지 않고 물질 전달 과정도 없다. 그러나 전극의 전위가 높아지거나 낮아지면 전기화학 반응이 일어나 전류가 흐르기 시작하는 비이상성을 실제 전극은 보인다. 이와 반대로 전극의 전하 전달 저항 및 물질 전달 저항이 없으면(=전하/물질 전달 과전압이 없으면), 전기화학 반응이 빠르게 진행되어 전극 전위는 일정하게 유지된다. 그림(b). 그러한 전극을 이상적 비분극 전극(ideally nonpolarizable electrode)이라고 한다. 그러나 전류가 증가하면 비이상성이 실제 전극에서 나타난다.
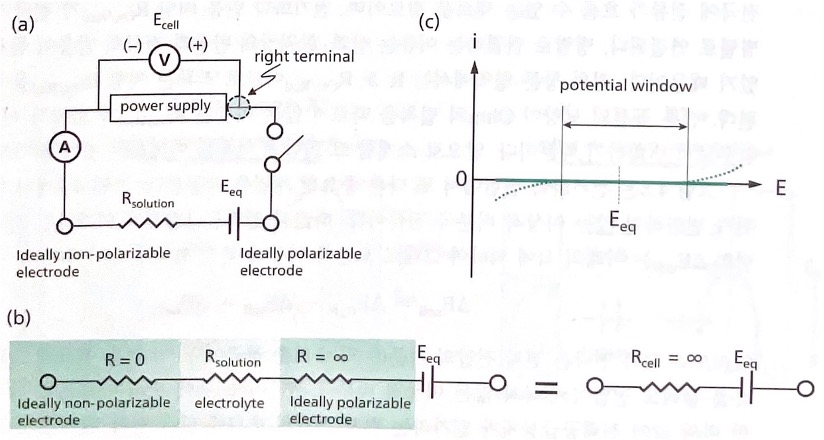
분극 곡선을 실험적으로 얻기 위해서는 전극 두 개와 전해질이 필요하다. 아래 그림(a)와 같이 이상적 비분극 전극(R=0) 두 개와 용액 저항이 Rsolution인 전해질로 구성된 전지를 생각해 보자. 전력공급장치의 스위치를 열어 놓으면, 전압계의 값은 두 전극의 평형 전압인 열린 회로 전압(OCP, open circuit potential) Eeq가 되고 전류계의 값은 0이된다. 스위치를 닫고 전력공급장치가 전류 i를 공급하면 두 전극 사이에 저항 성분 Rsolution만 있으므로 기울기가 1/ Rsolution인 굵은 실선의 직선, 즉 Ohm의 법칙을 따르는 곡선을 관찰할 수 있다.
그림(c)의 의미를 논의하기 위하여 그림(a)의 오른쪽 전극에 관점을 고정한다. 스위치가 열린 상태인 OCP인 상태에서 Eeq > 0이므로, 오른쪽 전극의 자발적 반응은 환원반응이다. 스위치를 닫고 전력공급장치 오른쪽 단자의 전압을 Eeq보다 높여(Eeq > Ecell) 양의 전류를 공급하면, 전자가 전극에서 나가는 산화 반응이 오른쪽 전극에서 진행된다. 오른쪽 전극에서 비자발적 산화 반응이 진행되므로 Eeq > Ecell구간에서 전지는 전해 전지로 작동한다.
반대로 오른쪽 단자의 전위를 Eeq 보다 낮추어(Eeq < Ecell) 음의 전류를 공급하면, 전자가 전극으로 들어가는 환원 반응이 오른쪽 전극에서 진행된다. 오른쪽 전극에서 자발적 환원 반응이 진행되는 전지는 갈바니 전지로 작동한다. 그렇다면 그림(c)는 그림(a)의 왼쪽 전극 전위가 일정하다는 조건에서 오른쪽 전극의 전위에 대한 곡선이다.

실제 전극에서 전류가 증가하면 비이상성이 나타난다.1그 비이상성을 위의 그림(c)의 점선으로 나타낸 다. Eeq를 기준으로 오른쪽은 전해 전지이므로 같은 양의 산화 전류를 흘리기 위해 실제 전위는 이상적 전위보다 더 높아야 한다. 이상적 전위와 실제 전위 사이의 차이, 즉 실선과 점선의 전위 차이가 과전압(𝜂cell)이다.
Eeq를 기준으로 왼쪽은 갈바니 전지이다. 여기에서도 마찬가지로 환원 전류가 증가하면 과전압이 나타 나며, 그로 인하여 이상적 전위보다 더 낮은 실제 전위를 인가해야 환원 반응을 유도할 수 있다.
그림(a)는 이상적 비분극 전극(R = 0)과 이상적 분극 전극(R = ∞)이 용액 저항이 Rsolution인 전해질을 사 이에 두고 연결된 전지이다. 위의 사진과 달라진 점은 오른쪽 전극이 이상적 비분극 전극에서 분극 전 극으로 대체되었다는 것이다. 이상적 분극 전극의 저항이 무한대이므로, 아래 그림(b)와 같이 등가회로 의 저항값도 무한대이다. 그러므로 이러한 전지는 그림(c)의 굵은 실선과 같이 전지 전압을 변화시켜도 전류가 흐르지 않는 i-E 곡선의 특징을 보인다. 전위에 따라 이상적 비분극 전극(left)은 전류를 흘릴 수 있지만, 전류를 받아야 하는 이상적 분극 전극(right)의 저항이 무한대이므로 전류가 흐를 수 없다. 따라서 전지에 전류가 흐르기 위해서는, 흐르는 전류를 수용하기 위한 전기화학 반응이 두 개의 전극 에서 동시에 일어나야 한다. 이 조건이 지켜지지 않으면 그림(c)와 같이 흐르는 전류는 없다. 실제로 존 재하는 이상적 분극 전극은 없으므로, 전지 전압이 높아지면 이상적 분극 전극(right)이라고 가정한 전 극에서 산화 반응이 일어나 𝑅cell ≪ ∞이 되고 양의 값을 갖는 산화 전류가 흐른다. 전압이 낮아지면 같은 이유에서 음의 전류가 흐른다.
그림(a)의 오른쪽 전극이 이상적 분극 전극으로 작동하는 전압구간에서는 그림(c)와 같이 전류가 흐르지 않는다. 전해질에 Red와 Ox가 존재하면, 아래 그림(a)에서 굵은 실선으로 표시된 Red의 산화전류와 Ox의 환원 전류를 산화/환원쌍의 평형 전위의 오른쪽(산화 전류)과 왼쪽(환원 전류)에서 각각 관찰할 수 있다.

그렇다면 얇은 실선으로 표시한 i-E 곡선은 산화/환원쌍이 없는 상태의 바탕 전류 곡선(background current curve)이 된다. 바탕 전류 곡선의 전류가 0인 이상적 분극 전극이 Red 혹은 Ox의 전류를 관찰 하는 전기화학 연구에 적합하다. 그러나 실제 분극 전극은 전압이 높거나 낮으면 전해질/전극의 게면 에서 전기화학 반응이 일어나 전류가 흐르므로 바탕 전류가 증가하여 관심 대상인 산화/환원쌍의 전류 와 중첩된다. 전해질/전극 계면에서 전기화학 반응이 일어나지 않는 전압 구간이 산화/환원쌍 연구에 적합하며 그림(a)의 초록색으로 표시한 영역을 전위 창문(potential window)이라고 한다. 실제로 사용 하는 분극 전극(R =∞)은 Pt, Au, Hg 그리고 유리질 탄소(glassy carbon) 등이 있으며, 이들의 전위 창문 이 전극을 구성하는 원소에 크게 의존한다.
그림(b)는 이러한 현상을 등가회로롤 표현한 그림이다. 산화/환원쌍의 존재는 이상적 분극 전극에 전류가 흐를 수 있는 새로운 경로이며, 전기화학 반응 저항 𝑅ox/red가 전극 자체 저항 𝑅∞과 병렬로 연결된다. 병렬로 연결하는 이유는 산화/환원쌍의 반응과 전극의 반응이 동시에 일어날 수 있기 때문이다. 전위 창문 영역에서는 전류가 𝑅ox/red(를 통하여 흐르게 된다. 전류 곡선이 Ohm의 법칙처럼 1/R 형태 로 나타나지 않는 이유는 𝑅ox/red가 화학적 이유에서 전위의 함수로서 변화하기 때문이다. 즉, 전극의 전위가 변화함에 따라 𝑅ox/red가 변화한다는 의미이다.

위의 그림은 전기화학 실험에서 또 다른 중요한 개념을 제공한다. 왼쪽 전극은 전위가 변화하지 않는 이상적 비분극 전극이다. 따라서 전력공급장치가 인가하는 전지 전압 𝐸cell의 변화 ∆𝐸cell은 아래의 식에 의하여 그대로 오른쪽 이상적 분극 전극에 인가된다.2
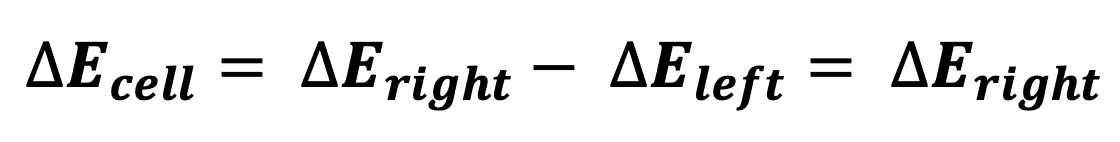
그러므로 왼쪽 전극은 전지 전압의 기준이 되는 기준 전극(reference electrode)이다. 이 기준 전극의 조건은 무한히 전류를 흘려도 해당 전위가 변하지 않는 이상적 비분극 전극이다. 이에 반하여 오른쪽 전극은 앞서 논의한 바와 같이 전력공급장치가 인가하는 전지 전압의 변화에 따라 산화/환원쌍 연구에 활용될 수 있으므로, 전기화학 실험에서 실질적 갖업을 한다고 하여 작업 전극(working electrode)이 라고 한다. 작업 전극에 흐르는 전류를 왼쪽 전극이 공급한다. 왼쪽 전극이 작업 전극을 상대한다고 하 여 왼쪽 전극을 상대 전극(counter electrode, auxiliart electrode)이라고 한다. 그러므로 위의 그림의 왼쪽 전극은 상대 전극과 기준 전극의 역할을 동시에 수행한다. 상대 전극으로서 작업 전극의 전류를 충분히 수용할 수 있고, 기준 전극으로서 전위를 일정하게 유지하는 이상적 비분극 전극을 사용하면, 관찰되는 분극 곡선은 작업 전극의 전기화학을 반영하게 된다.
cf) 전지 전압을 제어하고 전류를 측정하거나, 전지 전류를 제어하고 전압을 측정하는 두 가지 형태의 실험이 전기화학 연구의 기본적인 방법이다. 전지 전압을 제어하기 위해서는 일정 전위기 (potentiostat)를 사용한다. 전지 전압 제어는 과전압을 통하여 전하 전달과 물질 전달 속도를 제어하 고, 이에 따른 전류를 측정하여 전지의 전하 전달과 물질 전달 과전압 특성을 이해한다. 이러한 실험을 일정 전위 제어(potentiostatic control)라고 한다.
반면, 일정한 전류를 전지에 보내는 일정 전류기(galvanostat)를 사용하면, 전지에 공급하는 전류를 수 용하기 위하여 전지의 각 전극에서 전기화학 반응이 일어나며 각 전극에서 발생하는 과전압이 전지 전 압에 반영된다. 그러므로 전지 전압을 측정하면 전지의 과전압 특성을 이해할 수 있다. 이러한 실험을 일정 전류 제어(galvanostatic control)라고 한다.
- 갈바니전지에서는과전압과전해질전압강하에의해서산화전극의전위는더올라가고환원전극의전위는 더 내려가서 실질적으로 사용 가능한 갈바니 전지의 전압은 낮아진다. 반대로 전해 전지에서는 과전압과 전해질 전압 강하에 의해서 산화전극의 전위는 더 올라가고 환원 전극의 전위는 더 내려가서 전기화학 반응을 일으키기 위해서 power supply에서 가해줘야 하는 전압이 증가한다. [본문으로]
- 리튬 이온 전지에서 양극(cathode)과 음극(anode)은 모두 분극 전극으로 볼 수 있다. 리튬 이온 전지에서 충방 전 과정 동안 양극과 음극에서는 각각 산화/환원 반응이 일어난다. 이 과정에서 전극 전위는 반응이 진행됨에 따 라 변하게 된다. 예를 들어, 충전 시에는 양극에서 리튬 이온이 탈리되면서 산화 반응이 일어나고, 음극에서는 리 튬 이온이 삽입되면서 환원 반응이 일어난다. 이로 인해 양극과 음극의 전위는 각각 높아지고 낮아진다. 방전 시 에는 이와 반대로, 음극에서 리튬 이온이 탈리되고 양극에서 삽입되면서 산화/환원 반응이 일어나 전극 전위가 변하게 된다. 따라서 리튬 이온 전지의 양극과 음극은 충방전에 따라 전위가 변하는 분극 전극의 특성을 나타낸 다. 이들은 전기화학 반응이 실제로 일어나는 작업 전극의 역할을 하는 분극성 전극이라고 할 수 있다. [본문으로]
'Electrochemistry' 카테고리의 다른 글
| [Electrochemistry] 전류가 흐르는 전지와 과전압(3) (1) | 2024.10.06 |
|---|---|
| [Electrochemistry] 전류가 흐르는 전지와 과전압(1) (0) | 2024.09.15 |
| [Electrochemistry] 전기화학 전지의 전위차 측정(2) (1) | 2024.09.06 |
| [Electrochemistry] 전기화학 전지의 전위차 측정(1) (3) | 2024.09.02 |
| [Electrochemistry] 전지 전해질과 이온 이동(3) (0) | 2024.08.30 |