<1.1 전지>

전지를 회로를 연결하면 전류는 전지의 (+)극으로부터 전기저항(resistance)으로 표시된 부하(load)를 거쳐 (-)극으로 흘러간다. 이 과정에서 우리는 전지에 연결된 부하의 종류에 따라 필요한 일 또는 에너지를 얻게 된다. 좀 더 구체적으로 charge carrier인 전자가 전위가 낮은 (-)극에서 나와 load를 거쳐 전위가 높은 (+)극으로 이동한다.

전기화학 셀이 있다고 가정해 보자. 전극 1에 전자가 많고, 전극 2에 전자가 적다면, 이로 인해 두 전극 사이에 전압 차이가 발생한다.
전자가 많은 전극 1에서는 음전하를 가진 전자들 사이에 척력이 작용하여 전자의 퍼텐셜 에너지가 높아진다. 반면, 전자가 적은 전극 2에서는 전자의 퍼텐셜 에너지가 상대적으로 낮아진다. 이와 같이 두 전극 간의 전자의 퍼텐셜 에너지 차이는 전위차(voltage)로 나타난다. 따라서 전자는 전위가 낮은 전극 1에서 전위가 높은 전극 2로 이동하려고 합니다.
두 전극을 전자가 이동할 수 있는 전선으로 연결하면, 전위가 낮은 전극 1의 전자들은 전위가 높은 전극 2로 이동하게 됩니다. 이 과정에서 스위치가 전자의 이동을 허용하며, 이동하는 전자의 흐름을 전류(Current)라고 합니다. 또한, 두 전극을 연결하는 모터는 전자의 퍼텐셜 에너지를 다른 형태의 에너지로 변환하는 장치입니다. 모터의 출력은 두 전극 사이의 전압과 부하 저항에 의해 결정되는 전류의 곱으로 정의됩니다.
이와 같은 과정을 통해 전기화학 셀에서 발생하는 전기적 현상과 에너지 변환 과정을 이해할 수 있습니다.
<1.2 화학과 전기의 만남: 전기화학>
전기와 화학을 결합시키기 위해서는 화학의 반응성과 전극의 전위를 연결해야한다.
어떤 산화/환원쌍의 환원되려는 경향을 전자를 끌어당기는 환원 전위로 해석할 수 있고, 환원 전위가 높다면 전자의 수가 적은 상태로 간주할 수 있다.
<1.3전기화학 전지>

일반적인 산화/환원 반응과 전기화학반응은 구별할 필요가 있다.
산화/환원 반응은 두 반응물이 같은 공간에서 직접 전자를 주고 받는 반응이고, 전기화학 반응은 산화 반응과 환원 반응이 분리된 공간에서 일어나 외부 회로를 통하여 전자를 주고받는 산화/환원 반응이다. 물질의 변화라는 관점에서 보면 전기화학 반응은 산화/환원 반응과 같다. 그러나 전기화학 반응에서는 산화되는 물질은 전극을 통해 산화 반응 과정에서 내어놓는 전자를 외부 회로로 전달하고, 환원하는 물질은 전극을 통해 필요한 전자를 외부 회로에서 공급받아 환원 반응 과정이 진행된다.
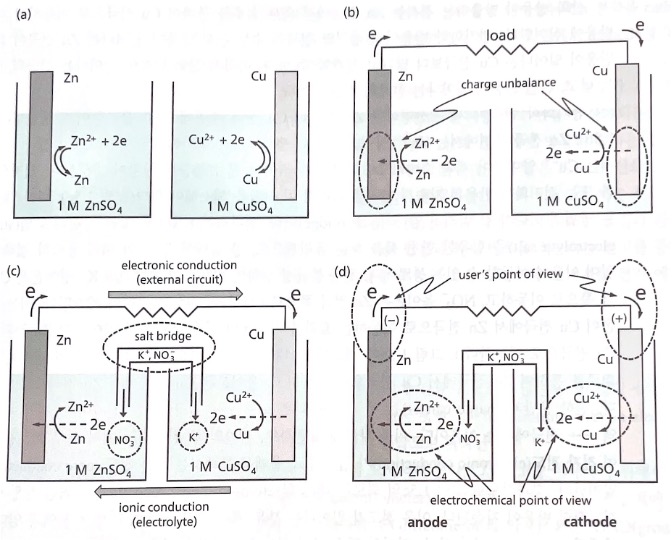
환원되려는 경향이 큰 Cu2+/Cu 산화,환원 쌍에서 Cu2+ 이온이 금속 Cu로 변화하는 환원 반응이 진행되고, 환원되려는 경향이 작은 Zn2+/Zn 산화,환원 쌍에서 금속 Zn은 Zn2+ 이온으로 변화하는 산화 반응이 진행된다. 전지의 전체 반응은 두 반응의 합인 금속 Zn의 산화 반응과 Cu2+ 이온의 환원 반응의 합으로 표현된다.
Zn 전극: Zn(s) -> Zn2+(aq) +2e : Anode
Cu 전극: Cu2+ + 2e -> Cu(s) : Cathode
전지 반응: Zn(s) + Cu2+ -> Zn2+(aq) + Cu(s)
전기화학 반응이 계속 진행되면 Zn 전극과 Cu 전극 주변에 전하 불균형이 발생한다. Zn 전극 주변에는 양이온이 계속 생성되므로 양전하가 많아지고, Cu 전극 주변에는 양이온이 계속 소비되므로 양전하가 적어진다. (전하 불균형) 이를 해결하기 위해 KNO3와 같은 강전해질 염을 사용한다.
전하 불균형이 발생하면 염다리의 K+ 양이온은 Cu 전극 쪽으로 이동하고, NO3- 음이온은 Zn 쪽으로 이동하여 전하 불균형이 해소된다.
음전하의 전자는 외부회로를 통하여 전자 전도(electronic conduction)가 일어나고, 용액을 통해서는 이온 전도(ionic conduction)가 일어난다. 결과적으로 이 전기화학 셀은 closed loop circuit이며, 이러한 상황에서만 전기화학 반응이 지속된다.
전기화학 전지를 다음과 같이 정리할 수 있다. 전지는 두 개의 전극과 이온 전도가 가능한 전해질로 구성된다. 산화 전극에서는 환원전위가 낮은 산화/환원 반쪽 반응이 산화되는 쪽으로 반응이 진행되어 전자를 방출한다. 산화 전극에서 방출된 전자는 전기 전도가 가능한 외부 회로를 통하여 환원 전극으로 이동하고, 환원 전위가 높은 또 다른 산화/환원쌍 반쪽 반응에 공급되어 환원 반응이 진행된다. 전해질에 존재하는 이온의 이동, 즉 이온 전도가 산화 전극과 환원 전극의 계면에서 발생하는 전하 불균형을 해소할 수 있다. 결국 산화되는 물질과 환원되는 물질의 화학 퍼텐셜 차이는 분리된 공간에서 산화 반응과 환원 반응을 허용하는 전지를 통하여 전위차(전압)로 변환되고, 전지는 외부 회로를 통한 전자의 흐름으로 화학 에너지를 전기 에너지로 변환한다.
'Electrochemistry' 카테고리의 다른 글
| [Electrochemistry] 전지 전해질과 이온 이동(2) (0) | 2024.08.30 |
|---|---|
| [Electrochemistry] 전지 전해질과 이온 이동(1) (1) | 2024.08.23 |
| [Electrochemistry] 전기화학의 전지(3) (0) | 2024.08.15 |
| [Electrochemistry] 전기화학의 전지(2) (0) | 2024.08.15 |
| [Electrochemistry] Introduction (0) | 2024.08.10 |