[Electrochemistry] 전류가 흐르는 전지와 과전압(1)
전기화학 전지에 전류가 흐르면 과전압이 발생한다. 전기화학 반응 제어는 전기화학의 가장 핵심적인 개념인 과전압 조절과 같은 의미이다. 원하는 반응의 과전압을 줄여야 하고, 원하지 않는 반응의 과전 압은 늘려야 한다. 그러므로 목표하는 전기화학 반응의 과전압을 측정하고, 전지를 화학적으로 조절하 여 원하는 방향으로 과전압을 제어하는 것이 전기화학의 전부이다. 제 4장에서는 과전압의 개념, 원인과 측정 방법을 다룬다.
<4.1 Faraday 법칙>
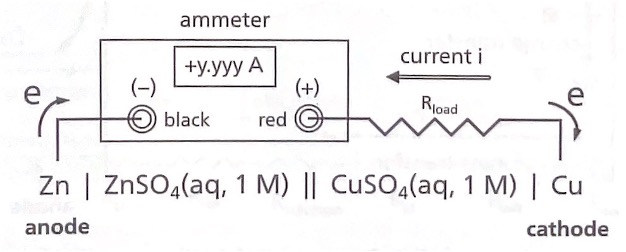
전기화학의 화학 양론부터 논의를 시작한다. 전기화학의 양론은 물질의 양과 전하량 사이의 관계를 다 룬다. 아래 그림의 Zn2+/Zn와 Cu2+/Cu의 산화/환원쌍 갈바니 전지에서는 다음의 반응이 진행된다.

전자는 Zn 산화 전극에서 외부 회를 통하여 Cu 환원 전극으로 이동하며, 이때 Cu 환원 전극에서 Zn 산화 전극으로 흐르는 전류 i를 전류계가 측정한다. 전류는 시간에 따라 변할 수 있는 물리량 𝑖(𝑡)이므 로, 전하량 Q는 다음과 같다.

Q를 Faraday 상수 F로 나누면 이동한 전자의 mol 수(=Q/F)를 계산할 수 있다.
소비된 Zn의 mol 수 = 전자의 mol 수 × (1molZn/2mol 전자)
생성된 Cu의 mol 수 = 전자의 mol 수 × (1molCu/2mol 전자)
이 관계를 𝑂𝑥+𝑛𝑒 ⇌𝑅𝑒𝑑 반쪽 반응에 대하여 일반화 하면 아래의 관계를 얻을 수 있다.
𝑸 = 𝒏𝑭(반응한 또는 생성된 물질의 𝒎𝒐𝒍 수) ∶ 𝑭𝒂𝒓𝒂𝒅𝒂𝒚 법칙
한편, 위의 식을 시간에 대하여 미분하면 전지에 흐르는 전류가 전기화학 반응의 속도라는 사실을 알 수 있다.

그러므로 전지에 흐르는 전류를 측정하면 전기화학 반응의 속도를 측정하는 것이며, 전류를 적분하면 반응의 양적 관계를 계산할 수 있다.
<4.2 전류가 흐르는 전지의 전압>
전지에 흐르는 전류는 전지에서 전기화학 반응이 어떤 속도를 가지고 일어나고 있음을 의미하며, 전류는 진행 중인 전기화학 반응의 반응 속도이다. 대부분의 전지는 전류가 흐르는 상황에서 사용하게 되고, 전류를 제어하는 것이 전기화학의 궁극적 목적이므로 전지 전류의 이해는 매우 중요하다.
전지 전류의 이해는 전기화학 반응이 표면 반응(surface reaction)이라는 사실로부터 출발한다. 그림(a) 에 나타냈듯이 전기화학 반응이 일어나기 위해서는 크게 두 가지 과정이 연속적으로 일어나야 한다.
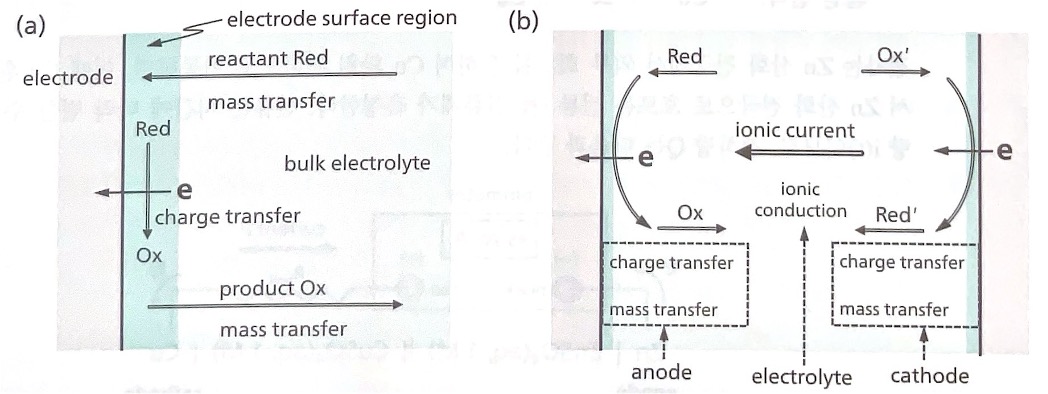
𝑅𝑒𝑑 →𝑂𝑥+𝑛𝑒 산화반응을 예로 생각해 보자. 반응물 Red가 전극 표면에서 생성물 Ox로 변환하는 화 학 반응은 전자를 전극에 전달하는 Charge Transfer 과정이다. 이러한 이유에서 전기화학 반응을 표면 반응이라고 한다. 반응물이 전극 표면에서 소비되므로, 반응이 지속되기 위해서는 벌크 전해질의 반응 물 Red가 계속 전극 표면으로 공급되어야 한다. 또한 전극 표면에 축적된 생성물 Ox는 벌크 용액으로 게속 이동해야 한다. 이러한 반응물과 생성물의 이동을 Mass Transfer 과정이라 한다.
그림(b)는 전체 반응이 𝑅𝑒𝑑 + 𝑂𝑥= → 𝑂𝑥 + 𝑅𝑒𝑑=인 전지에서 각각 반쪽 반응의 Charge Transfer과 Mass Transfer가 산화 전극과 환원 전극 모두에서 일어나야함을 보여준다.또한 두 전극 사이에 이온 전도를 위한 벌크 전해질에서 이온 이동도 필요하다.
전지 외부에서 관찰하는 전류는 화학의 관점에서는 반응 속도이다. 전기화학 반응의 속도인 전류는 그 림(b)에 도시된 연속된 다섯 과정(각 전극의 Charge & Mass Transfer 과정과 이온 전도를 위한 이온 이 동 과정(ionic conduction))에 의하여 결정된다. 다섯 과정 중에서 가장 느린 과정이 병목 현상을 일으 켜 전기화학 반응 속도를 결정하고, 최종적으로 전지에 흐르는 전류 크기를 결정한다.
다섯 과정 중 가장 느린 과정이 RDS → 반응 속도 결정 → 전류의 크기 결정
그림(b)의 각각의 과정을 전기의 관점에서 저항으로 표시할 수 있다. 전류는 반응 속도에 비례라고, 또한 전류는 저항에 반비례하므로 반응 속도와 저항의 관계는 반비례하다.

전기화학 반응 속도와 저항의 등가성을 기반으로 실제 전지를 이상적 전지와 저항으로 표현하는 등가회로는 전지의 이해뿐만 아니라 많은 전기화학 측정 기술의 이해에 매우 유용하다.
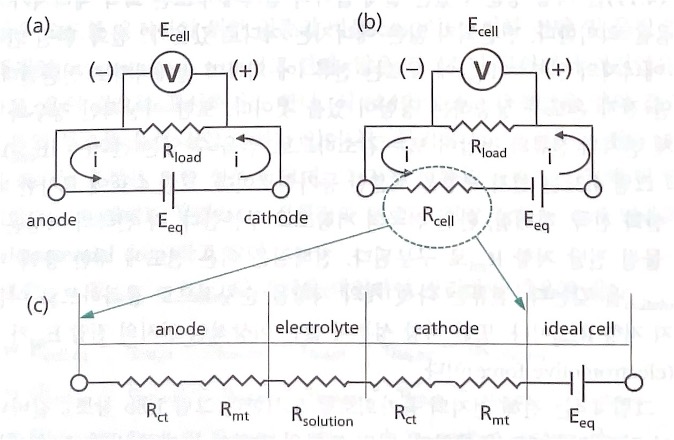
저항으로 표시된 전지에 흐르는 전류와 전압을 논의해 본다.
Zn2+/Zn와 Cu2+/Cu의 산화/환원쌍 갈바니 전지의 평형 전압(Eeq), 즉 Nernst 식에 의하여 전류가 흐르 지 않는 상황의 전압은 +1.10 V이다. 그림(a)에서 갈바니 전지를 전지 부호로 표시하고, 부하 저항 Rload와 연결하면 전류가 흐른다. Rload에 전압계 V를 병렬로 연결하면 전류가 흐는 상황에서 전지 전압 Ecell을 측정할 수 있다. 이상적인 전지, 다시 말해 저항 성분이 전혀 없는 전지를 가정한 회로가 그 림(a)이다. 이때 흐르는 전류 i는 다음과 같다.

따라서 전지 전압 Ecell은 다음과 같다.

다시 말해 이상적인 전지의 전압은 전류가 흐르더라도 Nernst 식으로 계산된 평형 전압과 같다.
실제 전지 안에서는 유한 크기의 전지 저항(Rcell)이 존재한다. 전류는 전압이 Eeq인 이상적인 전지에서 나와 Rcell을 통하여 흐르므로, 실제 전지는 이상적인 전지와 Rcell이 직렬로 연결된 그림(b)의 등가회로로 표현할 수 있다. 이 경우 전류 i는 다음과 같이 표현 가능하다.

그러므로 전지 전압 Ecell은 다음과 같다.
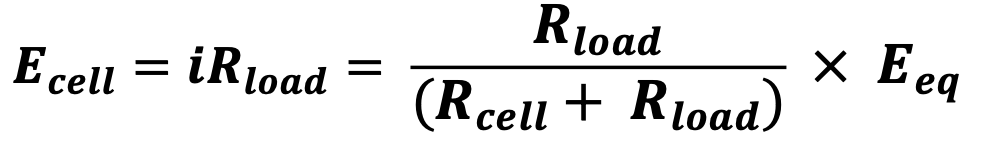
𝑹𝒄𝒆𝒍𝒍 > 𝟎이므로, 𝑹𝒍𝒐𝒂𝒅 < 𝟏이다. 이는 𝑬𝒄𝒆𝒍𝒍 < 𝑬𝒆𝒒임을 의미한다.
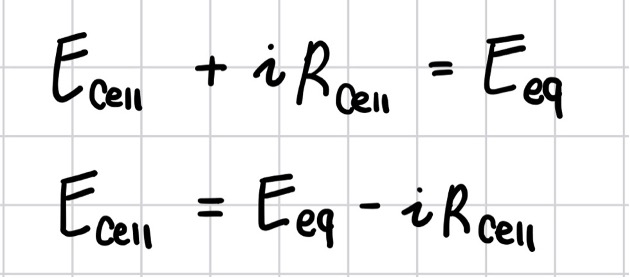
위의 식은 저항 성분이 있는 실제 갈바니 전지에서 모든 화학 에너지가 전기 에너지로 변환될 수 없음 을 의미한다.4 변환되지 않은 에너지는 어디로 갔을까? 산화/환원 반응 과정에서 방출되는 화학 에너지 의 일부는 Rcell에 흐르는 전류 i에 의해 열에너지로 전환된다. 전지에 많은 전류가 흐르면 전지 온도가 상승하는 경험이 있을 것이다. 또한 이상적인 경우와 실제적 경우를 비교하면 실제 전지의 전류와 전 압이 모두 감소하므로, 얻을 수 있는 전력(=iEcell)도 감소한다.
그림(c)는 저지 저항을 세분한 등가회로이다. 그림(c)에서 묘사한 바와 같이 저항 성분은 크게 산화 전 극, 전해질, 환원 전극의 저항으로 구분한다. 각 전극의 저항은 다시 전하 전달 저항 Rct와 물질 전달 저항 Rmt로 구분된다. 전해질은 이온 전도에 대한 용액 저항 Rsolution을 갖는다. 전류는 다섯 개의 저항 을 순차적으로 통과하므로 이들을 직렬로 연결한 것이 전지 저항 Rcell이다. 또한 저항 성분이 없는 이 상적인 전지의 전압 Eeq가 전류를 흐르게 하는 기전력(electromotive force)이다.

위의 그림은 전재 전지의 등가회로이다. 갈바니 전지와 동일한 저항 성분이 전해 전지에도 존재한다. 다만 전류의 방향이 반대로 바뀐다. 그 이유는 전지의 화학적 구성은 같지만. 화학 반응을 통한 전기 에너지의 획득(갈바니 전지), 혹은 전기 에너지를 이용한 화학 반응의 유도(전해 전지)라는 점에서 전지 운용의 방향이 서로 반대이기 때문이다. 전해 전지의 전압 Ecell 전력공급장치의 출력전압이다.
전지 전압(Ecell)과 전지의 각 저항 성분(Rcell)들의 관계를 설정한다.

각 저항 성분에 전류가 흐를 때 전압 강하 −𝒊𝑹이 일어나며, 전압 강하는 음의 값이다. 갈바니 전지의 Eeq는 양의 값이므로, 전지 저항의 존재는 전지의 출력 전압(Ecell)을 감소시킨다. 그러나 전해 전지의 Eeq 는 음의값이므로,저항성분을 극복할 수 있는 더 낮은 외부전압을 인가해야한다. 1
전류가 증가하면 전압 강하가 더 커짐에 주목한다. 다시 말해 저항 성분에 의한 전압 강하는 반응 속도를 유지하기 위한 일종의 cost이다.
전하 전달 및 물질 전달과 관련된 전압 강하를 과전압(Overpotential, 𝜼)이라고 한다. 많은 전기화학 문헌에서 과전압을 양의 값으로 표시하기도 하고, 음의 값으로 표시하기도 한다. 위의 식에서는 과전압 을 양의 값으로 표시하였으며, 그 앞에 음의 부호를 붙여 전압 강하가 일어나는 물리적 현상과 일치시 켰다. 따라서 일반적으로 과전압이 크다는 표현은 저항 성분이 크며, 그 저항 성분을 극복하기 위해 더 많은 에너지가 소비됨을 의미한다고 이해해도 무방하다. 전해질과 관련된 전압 강하는 전극 반응과 무관하므로 iR 전압 강하(iR potential drop)라고 한다.

위의 식 Ecat와 Ean은 다음과 같다.

Ecell(전지 전압)은 각 전극 전위와 전해질 iR 전압 강하의 합임을 나타낸다. 예를 들면 환원 전극 전위 Ecat는 Nernst 식으로 표현되는 Ecat,eq와 전하 및 물질 전달 과전압의 합으로 표현된다.

예를 들어 전해 전지에서 환원 전극의 평형 전위는 낮으며, 과전압은 환원 전극의 전위를 더욱 낮추고, 산화 전극의 전 위는 과전압으로 더욱 높아져 전체 전지 전압은 더욱 낮아지게 된다.(사진(b)) 갈바니 전지(사진(a))에서 도 같은 논리를 적용하면 전지 전압은 과전압이 있을 때 감소한다.
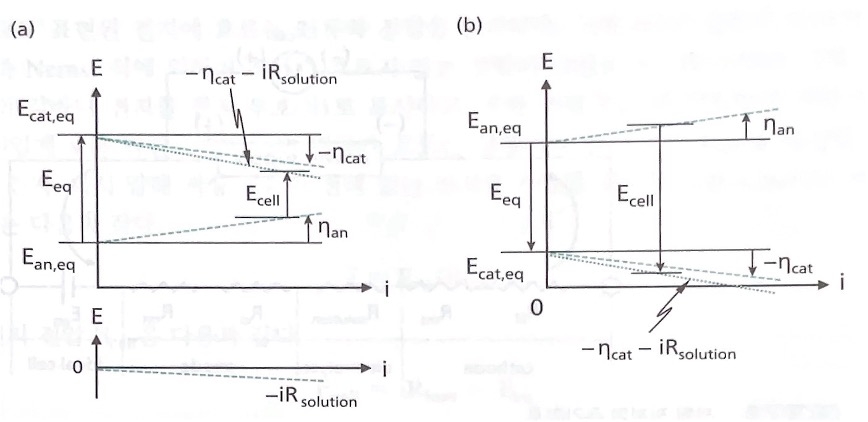
갈바니 전지에서는 과전압과 전해질 전압 강하에 의해서 산화 전극의 전위는 더 올라가고 환원 전극의 전위는 더 내려가서 실질적으로 사용 가능한 갈바니 전지의 전압은 낮아진다. 반대로 전해 전지에서는 과전압과 전해질 전압 강하에 의해서 산화전극의 전위는 더 올라가고 환원 전극의 전위는 더 내려가서 전기화학 반응을 일으키기 위해서 power supply에서 가해줘야 하는 전압이 증가한다.
위의 그림은 지금까지 논의한 과전압과 전지 전압의 관계를 요약하여 도시한 그림이다.


Cf) 전류 밀도, Current density, j
전기화학 반응은 표면 반응이다. 따라서 고체 전극과 액체 전해질이 접촉하는 모든 계면에서 반응이 발생하므로 전지 외부에서 관찰하는 전류 i는 전해질이 접촉하는 전극 면적에 비례한다. 서로 다른 전 극에서 관찰된 전류를 비교하기 위해서는 전류 i를 접촉 전극 면적 A로 나눈 Current density [A/cm2] 를 비교해야 한다. 그러므로 전기화학 문헌에서 전류를 정량적으로 비교할 때, 반드시 전류 밀도를 사용한다.
- 전해 전지에서는 평형 전압(Eeq)이 음의 값이기 때문에, 외부 전원을 통해 필요한 전압을 인가해야 비자발적인 화학 반응이 일어난다. 전해 전지 내의 저항 성분으로 인해 전압 강하(iR)가 발생하며, 이를 극복하기 위해 더 큰 외부 전압을 인가해야 한다. 이는 전류가 증가할수록 더 큰 전압 강하가 발생함을 의미한다.물의 전기분해에 필요한 평형 전압은 -1.23V이다. 만약 저항 성분으로 0.5V iR drop이 발생한다면, 전기분해 반응 을 일으키기 위해서는 power supply에서 -1.73V를 인가해야 한다. [본문으로]